- 국내 상위 20개 제약사 중 16개 사 cubeSAFETY R3 도입
- 제약사 51개 사, CRO 8개 사, 바이오벤처 3개 사에서 20만 건 이상의 전자보고에 활용
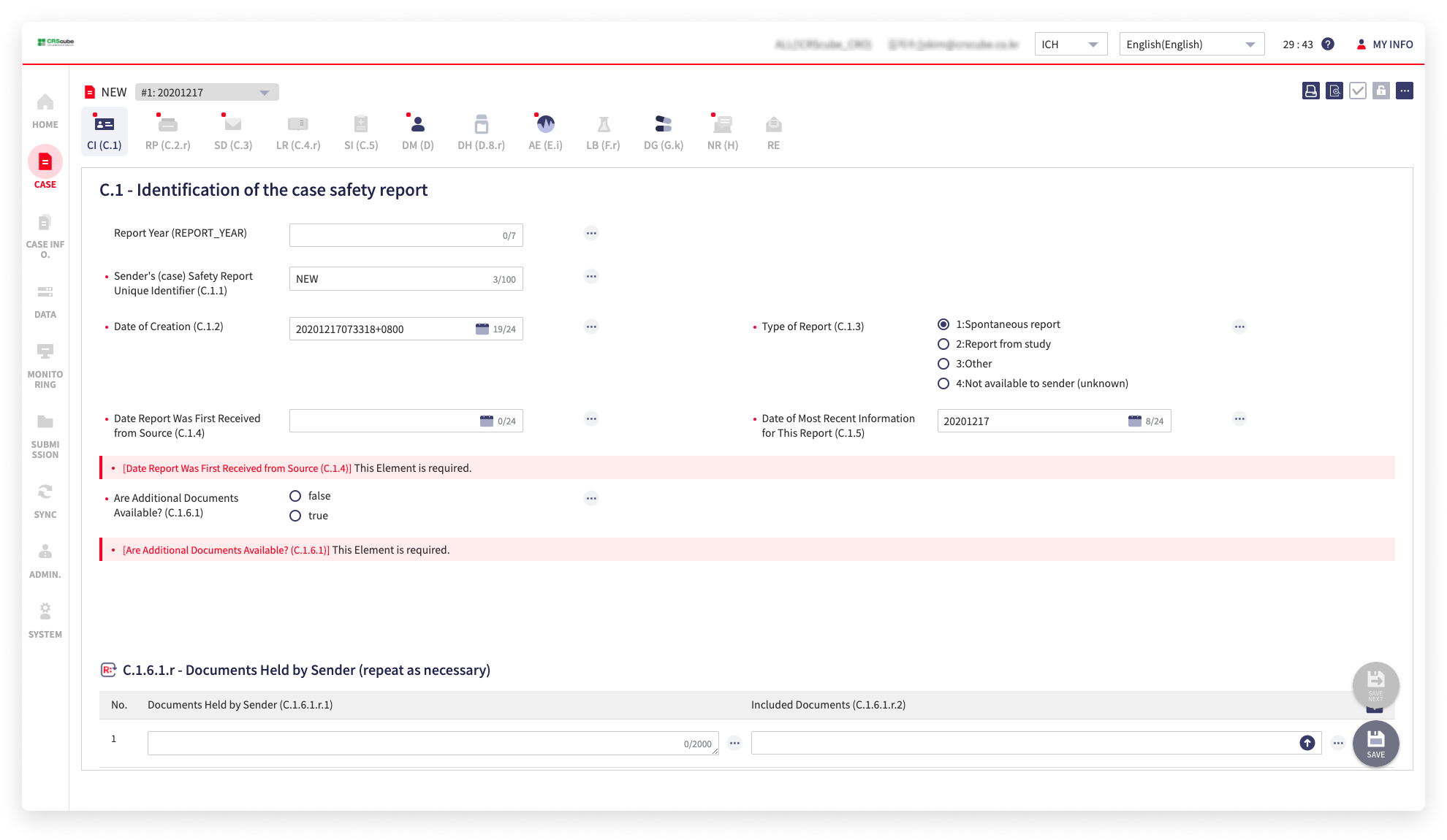
의료 임상시험 소프트웨어 솔루션 전문기업 씨알에스큐브는 ‘cubeSAFETY R3’의 국내 고객사가 60곳을 돌파했다고 19일 밝혔다. 국내 매출 순위 상위 20개 제약사(2022년 기준) 중 16개 기업이 ‘cubeSAFETY R3’를 도입하여 의약품 안전성을 관리하고 있다.
식약처는 국제 규제와 조화된 임상시험 관리를 위해 2016년 국제의약품규제조화위원회(ICH)에 가입한 이후 국제표준서식 E2B(R3)가 적용된 의약품 부작용 보고 선진화 시스템(KAERS-NeDrug)을 구축해 운영하고 있다.
해당 시스템에서는 개별 약물이상반응 및 이상사례 전자보고(ICSR)를 위해 ▲화면보고 ▲파일보고(XML 파일 업로드) ▲연계보고(XML 파일 전자 전송) 중 한 가지 방법을 이용해야 한다.
씨알에스큐브가 2019년 개발한 ‘cubeSAFETY R3’는 ICH E2B(R3)에 부합하는 의약품 안전성 관리 솔루션으로, 국내 시판 후 조사(PMS) 부문에서 70% 이상의 시장 점유율을 차지하고 있다. 제약사 51개 사, CRO 8개 사, 바이오벤처 3개 사에서 20만 건 이상의 전자보고에 활용하고 있으며, 이 중 2곳은 해외 업체의 솔루션을 사용하던 중 보다 효율적인 이상반응/유해사례(AE) 관리를 위해 cubeSAFETY로 데이터 마이그레이션 했다.
‘cubeSAFETY R3’는 약물이상반응 수집부터 보고까지 의약품 관리 전반을 혁신적으로 개선하여 복잡한 약물감시(PV) 업무를 간소화하고, FDA(미국), EMA(유럽), PMDA(일본), NMPA(중국) 등 주요 규제당국의 규정을 모두 충족해 지역별 구현 가이드라인(IG)에 효과적으로 대응한다.
특히, 임상시험 자료 수집을 위한 cubeCDMS와 연동되어 임상시험 중 발생하는 이상반응을 실시간으로 관리할 수 있으며, 9월 기준 180건의 임상 연구에서 EDC를 연동해 의약품을 관리하고 있다.
씨알에스큐브 관계자는 “씨알에스큐브는 국내 임상시험 솔루션 분야의 선두 주자로서 오랜 시간 쌓아온 경험과 고객 신뢰를 바탕으로 결실을 내고 있다”고 설명하고, "최근 해외 Safety DB 서비스를 이용하던 고객들이 안정적인 시스템과 서비스를 제공하는 씨알에스큐브 Safety DB로 옮겨오는 사례가 늘고 있다"고 밝혔다.
또한 “앞으로도 글로벌 표준을 기반으로 솔루션 기능과 서비스를 지속 확대하며 고객과 동반성장을 추구하는 임상 파트너의 역할을 강화해 갈 것”이라고 강조했다.
한편 씨알에스큐브는 오는 11월 14일 서울 여의도 콘래드 호텔에서 고객사를 대상으로 cubeSAFETY User Meeting 2023을 개최해 최신 규정 및 사용자 경험을 공유하고, 업계 관계자들의 교류와 협력을 촉진할 예정이다.
#씨알에스큐브#cubeSAFETY#








